事業進捗報告会 書き起こし記事
実施日時:2023年10月20日(金)
登壇者
代表取締役社長 浦田 泰生
ファシリテーター 池辺 愛
(国立大学法人 東京学芸大学 助教 / MC / ナレーター 等)
免責事項について
オンコリスバイオファーマ(以下、「当社」)は、以下に記載の情報についてあらゆる面から細心の注意を払っています。 しかしながら、当社は下記に掲載される情報の最新性・有用性・網羅性その他内容についてのいかなる保証も行うものではありません。また、当社は事前にお知らせすることなく、当社の判断によって公開されている情報の追加、変更、修正、削除、公開中断、公開中止等を行う場合があります。当社は、ご利用者各位が情報の掲載、追加、変更、修正、削除、公開の中断、中止等により生じたいかなる損害についても責任を負うものではありません。下記情報の掲載は、投資勧誘を目的としたものではありません。実際に投資を行う際は、ご利用者各位のご判断で行うようにお願い致します。さらに、下記記載の情報のうち、将来的な事項については、事情の変化等により変更されることがありうることをご留意ください。以上の点について、あらかじめご了承ください。

- 池辺愛氏(以下、池辺):
- これより「事業進捗報告会」を始めさせて頂きます。本日、司会進行及びインタビュアーを務めさせて頂きます、池辺と申します。浦田社長、本日は何卒宜しくお願いいたします。
- 代表取締役社長浦田泰生(以下、浦田):
- 宜しくお願いいたします。
- 池辺:
- 浦田社長にお会いするのは今日が2回目となりますが、今日も物凄くエネルギッシュでいらっしゃいますね。
- 浦田:
- よく、そう言われますね。
- 池辺:
- 今日はどのようなお話を伺えるのか楽しみにしております。それでは早速、内容に移っていきたいと思います。まず始めに本日ご説明頂く内容について教えていただけますでしょうか。

- 浦田:
- スライドの通り、今年は幾つか達成したいと思っている項目がございまして、本日はその中の臨床試験のトップラインデータが出てまいりましたので、10月16日プレスリリースを私からもう少し詳しくご説明申し上げたいと思います。
それ以外の事業の進捗状況につきましても若干述べさせて頂きたいと考えております。 - 池辺:
- 「食道がんにおけるPhase2臨床試験のトップラインデータ」についてご説明頂けるということですね。前回の事業進捗会で、浦田社長が「トップラインデータの公表予定」を説明している箇所が、YouTube再生のピークを記録しており、投資家の皆さまのご関心も高い点かと考えております。そもそも、なぜテロメライシンを食道がんの治療薬として開発しようと、オンコリスは考えたのでしょうか?
- 浦田:
- テロメライシンとは、腫瘍溶解性ウイルスという、がん細胞に感染してがん細胞を壊すウイルスですけれども、世界でこういったことをやっている会社は数十社ございまして、どの会社もどういう適応疾患を狙うべきか試行錯誤しているわけです。
私もテロメライシンに取りかかって約20年経ちましたけれども、創業者であります岡山大学消化器外科の藤原教授との議論を長い間重ねてまいりまして、テロメライシンのターゲットを「食べ物の入り口から出口まで」と定めました。例えば、口・喉・消化管・肛門などがターゲットになるのではないかと考えていましたが、中でも最もアンメットメディカルニーズという「医療上のニーズは非常に高いが薬がない領域」に焦点を当て、最終的に決めたのが食道がんという病気でした。
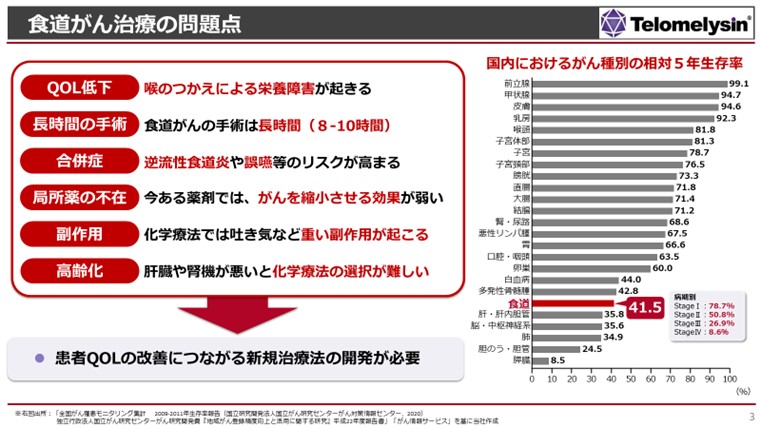
全身に転移してしまった食道がんの患者さまを全身治療で長生きさせましょう、という治療法はありますけれども、食道がんの腫瘍そのものに対して縮小させるような治療ができる薬は世界中にないわけです。我々はそこに注目しました。 - 池辺:
- 食道がんの患者様にとっては薬がないというのは非常に不安ですし、たくさんのお困りごとを抱えていらっしゃるということですよね。
- 浦田:
- そうですね。食道がんというのは直近の日本国内の結果ですけれども、5年生存率は他のがんと比較して下から6番目であり、食道がんはまだまだ治らない、あるいは治っても手術の合併症含め、治療に際して重篤な副作用を抱えておられる方が多くいらっしゃるということです。
- 池辺:
- つまり、新しい治療方法が必要であるということですね。そういった十分に満たされていないニーズを充足させるために開発したテロメライシンという薬は、どのような特徴を持っているのでしょうか。
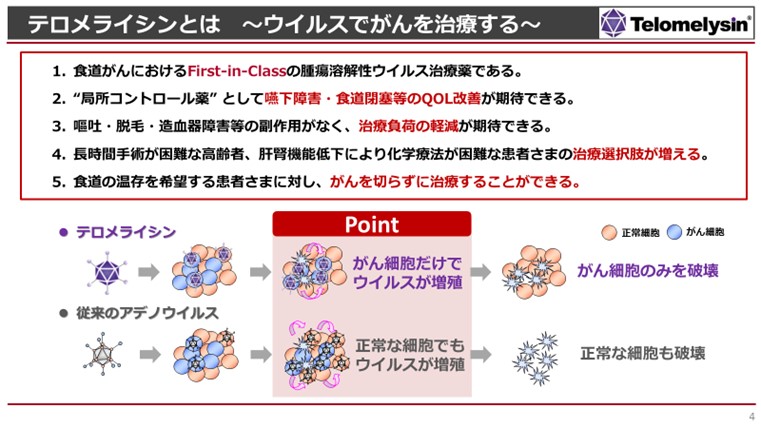
- 浦田:
- 先ほど申し上げた通り、我々が子どもの頃に扁桃腺炎という喉が炎症を起こすような病気がありますけれども、これを引き起こすウイルスがアデノウイルスといいます。そのアデノウイルスを一部遺伝子改変して「がん細胞では増えるけれども、正常な細胞では増えない」というように遺伝子改変をしたウイルスがテロメライシンです。
- 池辺:
- そんなことができるのですね。
- 浦田:
- 理論上はできましたけれども、臨床試験で本当にその効果を確認できた医薬品は世界でもまだ数少ない状況です。
- 池辺:
- ウイルスを使ってがん細胞だけを破壊するのは、新しい治療方法ですよね。
- 浦田:
- そうですね。考え方は1990年代からありましたが、医薬品として患者さまに届けるということに関して、アデノウイルスの分野では我々が世界で初めてになる可能性があります。
- 池辺:
- 食道がん治療の問題点を解決できるかもしれない、ということだと思いますが、どのような臨床試験を実施されたのでしょうか?
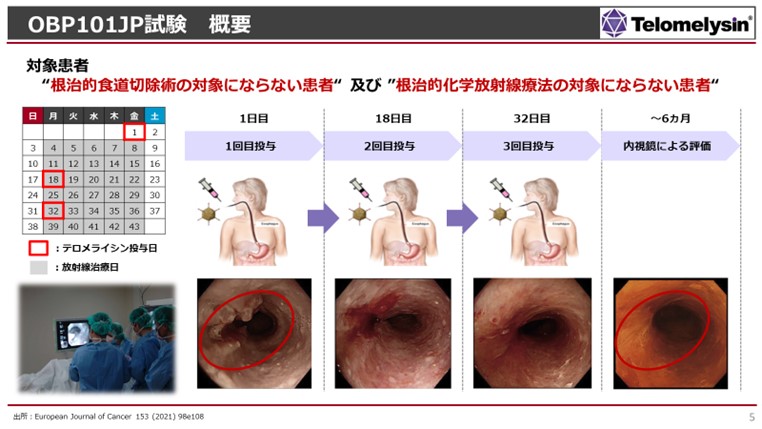
- 浦田:
- 我々が創業以来持っているコンセプトは「がんを切らずに治療したい」ということです。手術というのは患者さまにとっても大きな負担ですし、術後にも色々な合併症が残るわけです。では、切らずに治療できる領域が何かと探した結果、先ほどお話した通り食道がんというアンメットメディカルニーズの領域を選びました。本当は、テロメライシン単独で食道がんに効くかどうかを見たかったのですが、現在食道がんは化学療法あるいは化学放射線療法という治療方法が第一選択薬になっており、最近では免疫チェックポイント阻害剤も併用する治療になっています。それ以外ではオペをするのか、若しくは放射線治療単独で、あまり副作用がなく患者さんにも負担が少ないような治療が選択されるわけです。そういった標準治療を行わなければならない状況下で、標準治療ができない患者さまはどんな状態だろうと考えました。例えば、放射線単独でしか治療できないような方は、高齢患者さまが多いですね。要するに、心臓が悪い患者さまは、8時間から10時間かかる食道がんの手術に耐えることが大変なわけです。高齢者で心臓が弱い方は、当然手術に耐えられないです。また、化学療法では、髪の毛が抜けたり、毎日吐き気がひどかったり、しびれが出たりと、副作用に耐えられない患者さまもいらっしゃいます。例えば肝臓・腎臓に障害がある方は、化学療法を選択できないので、放射線治療しか選ぶ方法がありません。今回の臨床試験では、そういう患者さまを組入れました。
放射線治療というのは、スライドの通り、6週間かけて月曜日から金曜日まで毎日ベッドで治療を受けます。喉に炎症が起こることなどが起こり得ますが、がんの症状に比べたら非常に負担が小さい治療法です。この期間中に、カレンダーの赤枠で囲っているようにテロメライシンを「2週間おきに3回」、内視鏡的で長いカテーテルを通して、食道がんの患部に5ヶ所以上注射をします。注射をするとテロメライシンが局所で感染する仕組みです。こういう試験に組んで参りました。 - 池辺:
- その臨床試験の結果を16日にプレスリリースで発表されたということですね。
- 浦田:
- そうですね。今回発表した試験の前に、岡山大学では臨床研究やPhase1試験をやっておりまして、その段階で大体50%以上の方が、食道がんの縮小あるいは消失が認められることがある程度分かっていましたので、Phase2は企業治験として全国の17の臨床施設で再現性を確認した試験になっています。
- 池辺:
- 16日に発表されたプレスリリースを拝見しましたが、日常生活では見慣れない専門用語があり、教えて頂ければと思います。個人投資家の皆さまからも事前質問という形で頂いております。「L-CR率」、「L-RR率」とは、どのような意味なのでしょうか?

- 浦田:
- 本スライドの通り、L-CR率とはLocal Complete Responseの略で「局所での癌が完全に消失した」ことを表しています。「内視鏡検査」及び「組織を取ってがんの有無を確認する生体検査」の両方で「全くがんがなくなった」という評価を得られたものをL-CRと言います。 では、食道がんの場合に、L-CRにならなかった人はというと、スライド下に記載してありますけれども、Non-CRかつNon-PD(PD:Progressive Disease「がんの進行」)という、要するに「完全に治ってないけれど、悪くもなっていない」というところに大きなポピュレーションがあります。そのNon-CR / Non-PDの患者さまの中にも、CRに近いがんもあるのではないかということで、食道学会が最近新しい概念を導入しました。これをL-RR(Local Remarkable Response)局所著効率と言います。この局所著効率の意義は、例えば「大きく非常に深いがん」があったけれども、治療してStage1と呼ばれるような初期のがんの状態に戻るかもしれません。完全には消えていないけれども初期のがんのような状態になれば、例えば「元々大きくて手術ができなかったが。内視鏡切除や光免疫療法という次の段階の治療に繋げる」ことができ、患者さまの治療選択肢を広げることできるかもしれません。この局所著効率にはそのような意義があり、概念が導入されることになりました。そして、L-RRの患者さんというのは予後がいい。つまり生存率が非常に高くなります。がんが進行している、あるいは、がんが縮小していない、そういう方は早くお亡くなりになるケースがありますが、このL-RRと判定された患者さまでは、非常に予後が良いという結果が出ています。
- 池辺:
- ありがとうございます。ご説明頂いた点を踏まえて、非常に気になるところですけれども、テロメライシンの効果について教えて頂けますでしょうか。
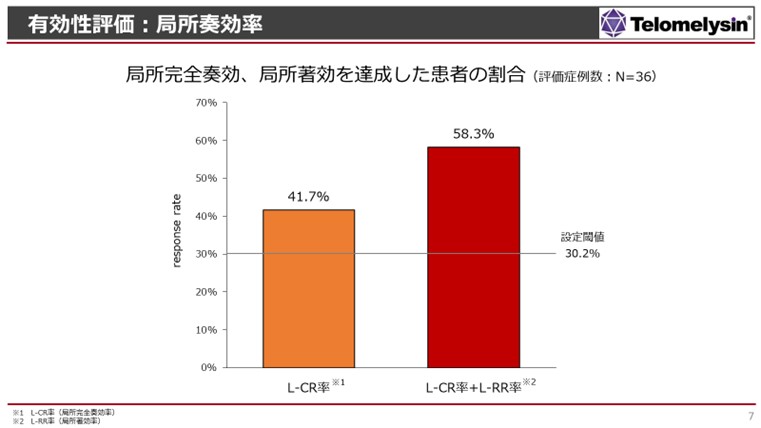
- 浦田:
- こちらが今回の結果ですけれども、内視鏡中央判定委員会の3名の先生方に、今回の治験の全ての症例の内視鏡結果を調べて頂いて、その中で41.7%の患者さまにおいて、誰が見ても完全にがんが消えているという結果が得られました。がんの臨床試験で、40%以上の患者さまで「がんが消失した」という試験は今まで世界でも報告されていません。この40%という数値が、高いのか低いのかという議論があると思いますが、我々としては非常に良い結果であったと考えています。
その基準として、スライドに30.2%の横線を引いていますが、これは有効性を判定するための閾値を表しています。10年以上前に食道学会で、全国から多くの症例を登録して頂いて、その時に「完全に治った、あるいは治っただろう」という患者さんが30%程で、特にステージ2、ステージ3という進行した患者さまにおいて、この基準となる数値が得られました。当社の臨床試験もステージ2、ステージ3の患者さまを対象としているため、有効性を判断する閾値として設定しました。
この食道学会のデータは、担当医の主観のもとで治っただろう、と判定された例もございますので、若干高い数字として出ている可能性があります。そして、確実にこの1つの基準である30.2%を上回ることができ、私たちは今回の臨床試験は成功したと考えています。右の赤い棒グラフですが、これは先ほど申し上げたL-RRという「著明にがんが縮小した」という方々も含めており、58.3%という結果が得られました。少なくともこの効果が得られた患者さまは、手術をしなくても生命予後が良くなるというような結果が出てきたことは非常に大きな結果です。もちろん、食道がんの患者さまにとっても、このように治療選択肢が増えるということは医療上大きな意味があると思っています。 - 池辺:
- 非常に良い結果が得られたということですが、率直なご質問ですけれども、ウイルスを使った抗がん剤と言いますと、どうしても安全面が気になってしまいますけれども、副作用についても教えていただけますでしょうか。

- 浦田:
- スライド下の通りです。今回臨床試験を行い、担当医によりテロメライシンと関連性があると判定された副作用のうち、主なものは発熱です。約半数の方において注射直後に熱が出ます。これは風邪を引いた時に熱が出ることと同じで、ウイルス感染の結果、約38℃から39℃の熱が一晩出る可能性があります。それから、もう1つリンパ球数減少またはリンパ球減少症がございます。約50%近く報告されていますが、これは放射線治療でも起こる副作用です。担当医からもテロメライシンか放射線かどちらの副作用か分からないけれど、少なくともテロメライシンに関連していると判断された方が約50%いらっしゃいます。この発熱やリンパ球減少は治験が終われば、また元に戻るため、不可逆的に何かが起こる、病気になるというような副作用ではありませんでした。今まで、アメリカやアジアで幾つか臨床試験を行ってきましたが、副作用プロファイルとしては同じようなパターンでございました。そういう意味では、化学療法のように髪の毛が抜けたり、肝臓・腎臓が悪くなるなど、そのような副作用は全くありませんでした。
<特に今回の臨床試験は平均年齢が83歳で、80代以上の患者さまが全体の4分の3を占める中で、この副作用結果が得られたことは、大変安全に使える薬ではないかと評価しています。
- 池辺:
- ご説明ありがとうございます。浦田社長ご自身は今回のテロメライシンの結果をどのようにご覧になっているのでしょうか。
- 浦田:
- 大変喜ばしい結果であり、治療の選択肢が限られており、新薬もほとんど出てこない食道がん治療に新しい選択肢が出てくることは大変有意義であると考えています。私だけではなく、この臨床試験を実施して頂いた主要な臨床家の先生方も大変意味のある結果であると評価して頂いています。
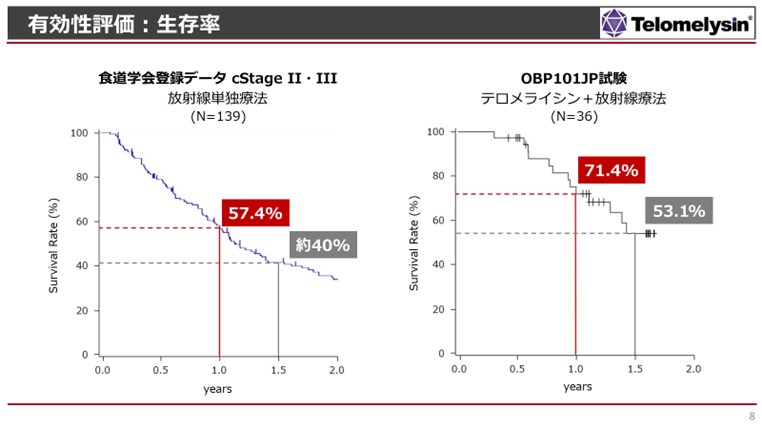
- 浦田:
- 生存率に関して、左側の結果が食道学会の約10年前の結果ですけれども、1年生存率が約57%、1年半の生存率になると約40%、期間が経てばさらに生存率は下がっていきます。右側のグラフの今回の試験の生存率を見ますと、約70%の患者さまが1年間生存でき、1年半経っても約53%生存することができています。ただ、この中には、がんでお亡くなりになった方ばかりではなく、例えば放射線による影響で肺炎になったり、他の疾患でお亡くなりになったと思われる患者さまがいらっしゃいます。したがって、本当にテロメライシンの臨床試験で、がんだけでお亡くなりになった方というのは今日まで、まだ1人、2人しか報告されておらず、今後フォローアップを行い、長期生存を見ていく予定ですけれども、大変良い生存率の結果であると評価しています。
- 池辺:
- 投資家の皆様から頂いた事前質問にもありましたが、本日、浦田社長からご説明頂いた他にも、何か「臨床的ベネフィット」がありましたら是非教えていただけますでしょうか。
- 浦田:
- 食道がんの患者さまにおいて最も生活の質を低下させてしまう要因は、嚥下障害、つまり「飲み込めない」ということです。嚥下障害のあった患者さまの結果を追ってみると、大体7割以上の方が、ものが飲み込めるようになったという結果があります。特に水分しか飲めないような方もいらっしゃいましたが、そのような状態のほとんどの患者さまが流動食あるいは固形物まで飲み込めるようになったというような結果になっています。食道がんの治療で1番問題になるのは、物が食べられなくなることです。どれだけ全身治療をしても、結局食べられないから、体も元気がなくなり、免疫も上がらず、予後が良くなくなってしまう患者さまもいらっしゃいます。今回、食べられるようになった患者様方は、大変お元気になって退院されたと聞いております。
- 池辺:
- ものが飲み込めるというのは大きな喜びですもんね。精神的にもいい影響が与えられるということですね。今回の結果を発表されるにあたり、医師による専門委員会が開催されています。個人投資家の方から事前質問として頂いていますが、臨床現場の先生方と浦田社長がお話をされた際に、興味深いエピソードなどございましたら、お話できる範囲で構いませんので是非教えていただけないでしょうか。
- 浦田:
- 多くの先生方のお話を伺いました。どの施設にも有効例が出ておりまして、その中でもがんの長さを測ると1番長い径で15cmぐらいの大きな腫瘍があったと聞いています。結果的にその方は著明な縮小を示しまして、先生方もこれだけ効くとは思ってなかった、とお声を聞いておりまして、それなりの効果があったのではないかと思っています。
- 池辺:
- 現場の先生方のお声というのは、本当に説得力のあるものですよね。
- 浦田:
- そうですね。食道がん治療で、化学療法を受けられて社会復帰しておられる方も沢山いらっしゃると思いますけれども、今回の試験でも社会復帰された方はたくさんいらっしゃいます。普通に退院ができて、普通の食事ができて、普通の生活ができるようになったというお声を聞いておりまして、それは大変心強い結果だと思いますね。
- 池辺:
- 本当に嬉しいですよね。さて、10月16日に発表されたプレスリリースでは「2024年下半期の承認申請に向けて準備を進める」と述べられています。投資家の方からも実は多くご質問をいだいているのですが、テロメライシンの有効性が確認され患者さまもテロメライシンを待ち望まれていると思いますが、承認申請に際して、具体的にここからどのような準備に時間が必要なのか、こちらについてもお話し聞かせていただけますでしょうか。

- 浦田:
- 大変重要なところですけども、承認申請に向けて大変膨大な資料をPMDAあるいは厚生労働省に提出しなければなりませんが、今回トップラインデータが出て、その第一歩が固まりました。
それ以外にも製造においては、商用製造に向けて定期的に安定供給できるような体制にまでしていかなければならない、これは今まさに進めておりまして来年いっぱいかけて準備をしていこうと考えています。
次に流通について、国内で最終的にパッケージをして臨床施設に持っていけるような国内製造所との体制を作らなければいけません。国内製造所に関しては、前回の報告会で話した時には、半年ほど遅れそうであるとお話ししましたが、色々ネゴシエーションをしてまいりまして、国内製造所は予想よりは早く契約できるのではないかと少し明るいニュースも出てきています。
国内販売パートナーについて、実際に臨床現場で先生方に薬の説明をし、副作用の収集などもできる体制を作らなければいけません。このためには、国内の製薬メーカーとパートナーを組まなければなりません。現在、今回のテロメライシンのトップラインデータの結果をご覧になられて、話を聞いてみたいという会社さんが複数出てきておりまして、取り急ぎそういった会社さんも含めて、どういうパートナーと組んだらいいのかを再考し、急いで決めていこうと動いています。今株主の皆さまにお話しているのは年内に決めたいと申し上げていますが、年内に1社には絞って報告できればと考えています。
- 池辺:
- 確かにもちろん超えなければならないハードルはあるのでしょうけれど、希望の光というのはますます強まってきていますよね。
- 浦田:
- そう思います。医療現場の先生方もからも色々話を頂いていますし、ちょうど今、日本がん治療学会が行われるのですが、当社の社員も出向いて先生方と今回の結果について色々お話を聞いてみたり、積極的にディスカッションしていく予定にしています。
- 池辺:
- では最後に、浦田社長から投資家の皆さまへコメントを是非よろしくお願いいたします。
- 浦田:
- テロメライシンのトップラインデータに関しては、10月に発表するということで、なんとか皆さまとの約束は守られたのではないかと考えています。今回の結果は、色々な見方があります。第3相臨床試験のように、対照薬あるいはプラセボと比べて統計学的な有意差が出ましたという結果ではありませんが、当社のテロメライシンというのは、再生医療等製品という医薬品であり必ずしも統計学的有意差などを要求されているわけではありません。正しく臨床的な意義を説明できるだけのエビデンスをPMDAに提出していくわけですけれども、その準備が整ってきたと考えています。現段階では2024年末までの承認申請という目標は変えていませんし、おそらくPMDAも厳しく審査をすることになるとは思いますが、我々もそれに負けないだけのエビデンスを投げかけていきたいと考えています。特に、こういった承認申請まで自分たちが開発してきた薬を持っていけるということは、どんな製薬会社さんでも一生に1度2度あるかないかです。そう考えると現在、社員も承認申請に向かうということで大変エキサイトしていますし、その力を私は信じてこれからもやっていきたいと考えています。
以 上













